Meld je aan voor onze nieuwsbrief
Bij het aanmelden ga je akkoord met onze Privacy Policy
Geschiedenis
In 1780 werd lactaat voor het eerst beschreven door de Zweedse scheikundige Carl Wilhelm Scheele. Hij had in monsters van zure melk een zuur kunnen identificeren. Vanwege het feit, dat hij het zuur in melk had gevonden noemde hij hem ?mjölksyra? – of in het Nederlands melkzuur. Vroeg in het begin van de negentiende eeuw werd door andere scheikundigen gevonden dat lactaat ook aanwezig in andere dierlijke producten waaronder weefsels, zoals vlees of bloed, maar ook bijvoorbeeld in verse melk. In 1833 werd melkzuur gezuiverd en chemisch beschreven. 36 jaar later – in 1869 – is de ontdekking gedaan, dat er twee stereoisomeren van lactaat bestaan, het D- en het L-lactaat. In 1922 kregen de biochemici Otto Meyerhoff en Archibald V. Hill de Nobelprijs voor het onderzoeken van de energetische aspecten van het koolhydraatmetabolisme. Hierbij had Meyerhoff ontdekt, dat lactaat bij afwezigheid van zuurstof als bijproduct van de glycolyse wordt gevormd, ofwel de zogenaamde anaërobe glycolyse(1,2,3). Omdat lactaat een natuurlijk product is en derhalve ook in dierlijke producten voorkomt, wordt lactaat reeds lang bij de productie van voedsel gebruikt. Het wordt onder andere gebruikt om producten aan te zuren en daarmee houdbaarder te maken.
Fysiologie
De glycolyse
Evolutionair gezien zijn de glycolyse en lactaatvorming bijna even oud als het leven zelf. Bij de glycolyse wordt één molecuul glucose omgezet in twee moleculen pyruvaat, waarbij twee ATP en twee NADH + H+ worden gegenereerd. Onder stabiele en aërobe omstandigheden kunnen deze pyruvaat-moleculen de zogenoemde Krebs-cyclus in gaan. Hierbij wordt pyruvaat omgezet in cO2 en H2O. tevens worden bij elk molecuul pyru- vaat 18 ATP gegenereerd. Deze tweede stap vindt ook in de mitochondrien plaats en wordt oxidatieve fosforylering genoemd. Voor de glycolyse is echter de aanwezigheid van NAD+ in het cytosol noodzakelijk. Er zijn vele situaties waarbij pyruvaat in het cytosol gaat accumuleren. Om de glycolyse op gang te houden moet pyruvaat gereduceerd worden tot lactaat. Hierbij wordt tegelijk NADH + H+ geoxideerd tot NAD+ (4). In theorie wordt lactaat dus gevormd, wanneer de glycolyse sneller verloopt dan de Krebs-cyclus of als de Krebs-cyclus door bijvoorbeeld een tekort aan zuurstof niet kan verlopen. In de praktijk worden zowel in de sportfysiologie als in de Intensive care geneeskunde veel situaties gezien waarin de eerste situatie optreedt, namelijk een verhoogde lactaatproductie zonder anaërobe omstandigheden.
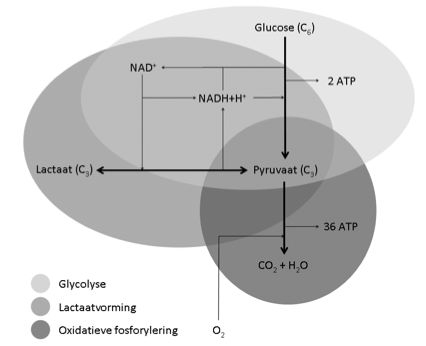
Figuur 1. Schematisch overzicht van de koppeling tussen het lactaat- en glucosemetabolisme.
Pathofysiologie
Traditionele indeling
In 1976 beschreef cohen hyperlactatemie als type a en type B hyperlactatemie. Deze indeling had twee basismechanismes ten grondslag, welke hyperlactatemie zouden kunnen veroorzaken. type a hyperlactatemie werd beschreven als een lactaatstijging op basis van een tekort aan zuurstof. Dit kan of lokaal zijn in het geval van hypoxie of systemisch optreden als hypoxemie. Type B hyperlactatemie werd beschreven als lactaatstijging op basis van een verstoring van de mitochondriele functie(5). Aangezien de meeste gevallen van hyperlactatemie blijken op te treden bij een adequate zuurstofspiegel en mitochondriële functie, voldoet deze indeling niet meer.
Moderne interpretatie
tegenwoordig weten wij, dat deze indeling veel oorzaken van hyperactatemie niet kan verklaren. Een voorbeeld is ?-adrenerge stress, waarschijnlijk één van de belangrijkste oorzaken voor een lactaatverhoging blijkt te zijn(6). Deze is noch bij de type a noch bij de type B van cohen onder te brengen. Echter dit heeft te maken met het feit, dat de glycolyse een veel eenvoudigere reactie is dan de oxidatieve fosforylering en ook veel sneller kan verlopen. Glycolyse kan 100 tot 1000 keer sneller verlopen dan de oxidatieve fosforylering. Ondanks de aanzienlijk lagere ATP- opbrengst van glycolyse (2 ATP ten opzichte van 38 ATP per glucosemolecuul) stelt deze een weefsel in staat om snel energie te kunnen produceren. Hierdoor wordt vervolgens natuurlijk meer pyruvaat geproduceerd. Op momenten van stress met verhoogde ATP-behoefte zal de oxidatieve fosforylering in de mitochondriën snel verzadigd raken, ongeacht de aanwezigheid van zuurstof. Als het pyruvaat op een bepaald moment de Krebs-cyclus gaat verzadigen, moet noodzakelijk lactaat worden gevormd om NaDH + H+ te oxideren tot NAD+ om de glycolyse te kunnen continueren.
Verschillende types lactaat
Men kent twee verschillende types van lactaat. Meestal spreken wij van L-lactaat als wij het in de dagelijkse praktijk over lactaat hebben. Deze linksdraaiende vorm van lactaat is de vorm van lactaat, die door de mens efficiënt verwerkt kan worden. Er bestaat ook een rechtsdraaiende vorm van lactaat, het D-lactaat. Deze vorm van lactaat wordt vooral door bacteriën en niet door de mens geproduceerd. In verband met een gebrek aan D-lactaatdehydrogenase is deze tevens voor de mens slecht te metaboliseren. Verder is L-lactaat gemakkelijker meetbaar dan D-lactaat. Om deze redenen meet de standaardbepaling in de dagelijkse praktijk het L-lactaat.
Lactaatmeting
Er bestaan verschillende methodes om lactaat te meten. Het referentiebereik voor lactaat is 0,5 tot 1,5 mmol/L. Lactaat kan in het laboratorium kunnen worden bepaald in zowel veneus als arterieel bloed. Het verschil tussen die twee metingen is in de regel gering: veneus lactaat is ongeveer 0,1 mmol/L hoger dan arterieel lactaat. Relevant hierbij is dat lactaat een erg stabiele verbinding is. Nadeel van een bepaling van lactaat in het centrale laboratorium is, dat deze procedure vaak vrij lang duurt totdat een waarde beschikbaar is. Bovendien kan lactaat in vitro in aanzienlijke mate worden gevormd als de pre-analytische fase langer duurt dan 10 minuten. tegenwoordig is het steeds gangbaarder om lactaatspiegels te bepalen met behulp van point-of-care bloedgasmeters. Deze werden in eerste instantie gebruikt om glucose snel te kunnen meten. Door toevoeging van een extra module kan vaak ook het lactaat worden bepaald. Dit heeft als voordeel, dat lactaat binnen enkele minuten beschikbaar is en tevens dat de meting ter plekke kan worden verricht.
Klinische relevantie van hyperlactatemie
Hyperlactatemie komt vooral voor in acute situaties. Uit een recente studie is gebleken, dat rond een derde van alle patiënten op de Intensive care unit een hyperlactatemie heeft(7). Lactaatspiegels zijn verder ook een relatief goede indicatie voor de prognose van een patiënt. Het is namelijk uit meerdere studies gebleken, dat hoge lactaatspiegels geassocieerd zijn met een hoge mortaliteit. Dit geldt zowel voor fors verhoogde lactaatspiegels (dat wil zeggen hoger dan 5 mmol/L) ten opzichte van patiënten met een normale lactaatspiegel als in patiëntcategorieën met intermediaire lactaatverhogingen. Verderop in dit artikel zal ingegaan worden op een aantal oorzaken van lactaatverhoging.
Lactaat gestuurd Intensive Care beleid
Lactaat is een parameter, welke relatief snel op veranderingen reageert. Gecombineerd met het bovenstaande is het klinisch vooralsnog een van de nuttigste indicators voor de klinische status van de patiënt. In het verlengde van de ?early goal directed therapy? volgens Rivers toonde recent onderzoek uit Rotterdam dat de lactaatspiegel als goal voor het bijstellen van een behandeling kan worden gebruikt. Dit is mogelijk dankzij de snelle daling van het lactaat als de behandeling aanslaat(8).
Relevantie van lactaat voor het lichaam
Vroegere mening over lactaat
Vroeger was de wetenschappelijke opvatting dat lactaat niet door weefsel kan worden gebruikt of zelfs schadelijke effecten hierop had. Dit had vooral te maken met het feit, dat lactaat casu quo melkzuur zo als de naam al zegt een ?zuur? is. Men had bijvoorbeeld als gedachte, dat de vermoeidheid en spierpijn na een zware lichamelijke inspanning door een accumulatie van lactaat in de spieren zou worden veroorzaakt. Deze theorie beruste op een onderzoek van Meyerhoff in 1920. Hierbij had hij een de spieren van een kikker met een elektrode laten contraheren. Na enkele contracties was het niet meer mogelijk om de spieren te laten contraheren. Onderzoek van het weefsel liet een verzuring zien, weliswaar zonder circulatie en zuurstoftoevoer. Hij concludeerde dat de daling van de pH de oorzaak was voor de spiervermoeidheid. Verder concludeerde men dat een verhoogd spierprestatie tot anaërobe omstandigheden leidt.
Lactaat shuttles
Het werd lang verondersteld, dat de enige mogelijkheid voor het lichaam om lactaat te klaren de cori-cyclus zou zijn, waarbij lactaat in de lever weer wordt omgezet in glucose – de gluconeogenese. Het transporteren van lactaat naar een andere plek in het lichaam noemen wij lactaat shuttles. Uit recente studies blijkt, dat het principe van lactaat shuttles nog verder gaat. Lactaat kan namelijk door veel weefsel direct of in veel ge- vallen ook regionaal als brandstof worden gebruikt. Hierin blijken vrijwel alle organen te participeren inclusief het hart, de hersenen, de darmen, de lever, de nieren en de spieren.

Tabel 1. Voorbeelden voor lactaat shuttles.
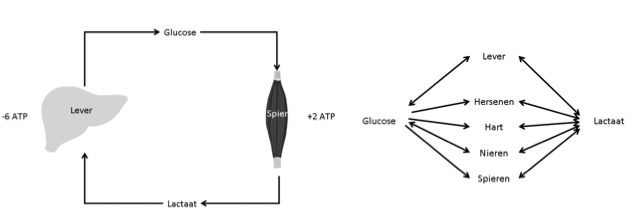
Figuur 2.
Lactaat shuttles: Figuur 2a laat de klassieke mening over het gebruik van lactaat in het lichaam zien – de zogenaamde Cori-cyclus. Hierbij kan lactaat alleen maar in de lever terug gevormd worden tot glucose. Merk op dat dit hergebruik van lactaat dus gepaard gaat met een ?verlies? van 4 ATP. Figuur 2b laat de lactaat shuttles hypothese zien, waarbij lactaat direct in het weefsel kan worden gebruikt – zonder verlies van ATP.
Klinische oorzaken van hyperlactatemie
Onder normale omstandigheden ziet men lactaatspiegels tussen de 0.5 en 1.5 mmol/l. Bij acuut zieke patiënten komen diverse omstandigheden voor die een verhoging van lactaat kunnen veroorzaken. Hieronder zullen wij daarvan een aantal belangrijke oorzaken kort bespreken. Hierbij valt op, dat er vaak meer dan een mechanisme (casu quo type volgens Cohen) ten grondslag ligt aan een bepaalde conditie.
Hartstilstand
De hartstilstand is wellicht het meest dramatische voorbeeld van een hyperlactatemie. Door het wegvallen van de circulatie ontstaat immers binnen een korte periode ernstige weefselhypoxie. Maar ook hier speelt ?-adrenerge stress een belangrijke rol(6). Deze veroorzaakt een directe stimulatie van de glycolyse. Wat vervolgens ook weer tot een lactaatstijging leidt.
Gegeneraliseerd clonisch-tonisch insult
Bij een gegeneraliseerd clonisch-tonisch insult spelen twee fenomenen, die het lactaat verhogen: ten eerste gaat door de verhoogde spieractiviteit en stress de ATP-behoefte dramatisch omhoog. Ten tweede is door het insult de ademhaling beperkt, waardoor de zuurstofaanbod afneemt(4).
Gestoorde leverfunctie
Bij een gestoorde leverfunctie kan de cori-cyclus niet meer plaatsvinden. Dit leidt tot een accumulatie van lactaat en kan daardoor een forse hyperlactatemie veroorzaken(10,11).
Sepsis
Sepsis, vooral ernstige sepsis, gaat vaak gepaard met hyperlactatemie. Vroeger werd verondersteld, dat de hoofdoorzaak hiervoor een gedepriveerde zuurstofaanbod op cellulair niveau zou zijn. Ook al zullen een verlaagde weefselperfusie en hypoxie zeker een rol kunnen spelen bij het ontstaan van hyperlactatemie, lijkt de hoofdoorzaak toch verhoogd ?2-adrenerge stress te zijn, aangezien het zuurstofaanbod bij deze gevallen meestal wél is gegarandeerd(4,9).
Adrenerge stress
Endogene stress in vorm van ?2-adrenerge stimulatie leidt op celniveau tot een stimulatie van de glycolyse als bron van energie. Dit gebeurt op basis van en sterk verhoogde N+K2+-ATPase activiteit(6). Er zijn dan ook meerderde mogelijkheden voor ?2-adrenerge stress. In eerste instantie maakt het lichaam in bepaalde situatie zelf adrenaline. Maar men kan hierbij ook denken iatrogene toediening van adrenaline of isoprenaline ter ondersteuning van de circulatie of bij een anafylactische reactie.
Shock
Ook een shock is klinisch een combinatie van verschillende factoren, die leiden tot een hyperlactatemie. Ten eerste wordt bij een shock natuurlijk door het lichaam adrenaline vrijgemaakt(12). Ten tweede kan een shock leiden tot weefselhypoxie en daarmee hyperlactatemie.
Intoxicaties
Er zijn veel intoxicaties, die een hyperlactatemie kunnen veroorzaken:
- Ethanol. Ethanol is waarschijnlijk de intoxicatie, die in de praktijk de hoogste incidentie laat zien. Bij ingestie van een klinisch significante hoeveelheid, is ethanol competitief voor het hepatische NADH+H+. Dat betekent, dat ethanol de instroom van pyruvaat in de cori-cyclus inhibeert en daardoor voor een verhoging van de lactaatspiegel zorgt(13);
- Methanol. Methanol beïnvloedt lactaatspiegels op twee manieren. ten eerste heeft het soortgelijke eigenschappen als ethanol. Het remt dus de mitochondriale instroom van pyruvaat. ten tweede wordt methanol gemetaboliseerd tot mierenzuur. Mierenzuur is giftig en inhibeert de mitochondriale cytochroomoxidase. Hierdoor kan de oxidatieve fosforylering niet meer plaatsvinden. De enige optie om energie te produceren is dan glycolyse en lactaatproductie(14);
- Antivriesmiddelen. Er zijn verschillende antivriesmiddelen, die bij ingestie tot een verhoging van lactaatspiegels kunnen leiden. Hierbij spelen verschillende componenten;
- Ethyleenglycol is één van de meest gebruikte antivries middelen. Het veroorzaakt zelf geen verhoging van lactaatspiegels. Maar een van de metabolieten van dit middel is glycolaat. Glycolaat heeft een structuur, welke zeer op lactaat lijkt. Daardoor kan het bij sommige point- of-care meters tot een vals positieve verhoging van lactaat lijken(15). Een intoxicatie met ethyleenglycol moet daarom bij een onverklaarde hyperlactatemie moeten worden overwogen. Het lactaat moet dan tevens gecontroleerd worden in het centrale laboratorium.
- Propyleenglycol kan ook een hyperlactatemie te kunnen veroorzaken. Een groot deel hiervan wordt namelijk in de lever middels alcoholdehydrogenase omgezet in pyruvaat. Dit leidt tot een forse overschoot aan pyruvaat met als consequentie de overmatige productie van lactaat(16).
Alkalose
Als op cellulair niveau een alkalose ontstaat, zal een biochemische terugkoppeling proberen de pH weer terug naar normaal te brengen. Dit gebeurt door stimulatie van de lactaatproductie.
Hyperventilatie
Een van de meest voorkomende oorzaken van alkalose is een psychogene hyperventilatie. Uit onderzoek met vrijwilligers was al bekend dat dit tot lactaatstijgingen kan lijden. Uit een recente studie op de spoedopvang van het UMc Groningen weten wij, dat ook in de klinische praktijk bij een hyperventilatie een verhoging van lactaatspiegels plaats kan vin- den(17).
Trauma
Bij patiënten met een groot trauma spelen verschillende factoren. ten eerste veroorzaakt het trauma natuurlijk stress, inclusief ?2-adrenerge stress(6). Maar ten tweede bestaat bij een groot trauma ook altijd de kans op een ernstig bloedverlies. Dit kan dan vervolgens leiden tot een shock met alle gevolgen daarvan.
Diabetes mellitus
Hyperlactatemie bij diabetes mellitus is multifactoriëel. Er kunnen zich allerlei situaties voordoen, welke invloed kunnen hebben op de lactaatspiegel.
Ernstige hyperglycemie
Forse hyperglycemie veroorzaakt vaak hyperlactatemie. Dit is gebleken in een studie met 186 patiënten, welke zich presenteerden met glucosewaardes boven de 300 mg/dl (ongeveer 16.7 mmol/l). Hierbij werd gevonden dat een ongeveer een kwart van deze patiënten ook een significante lactaatelevatie hadden(18).
Metformine
Het vermoedelijke werkingsmechanisme van metformine is recent opgehelderd. Een van de hoofdreden voor een lactaatstijging is het direct remmende effect van metformine op de mitochondriën(19,20). Bij een gestoorde nierfunctie kan na cumulatie over een aantal dagen een metformine-overdosering ontstaan met soms zelfs een ernstige ?metformin associated lactic acidosis? (MaLa). Gelukkig is de incidentie van MaLa, gezien het zeer wijdverbreide gebruik van metformine relatief gering(21).
Toekomstperspectieven
In de nabije toekomst zullen continue lactaatmetingen mogelijk worden. Dit zal nieuwe mogelijkheden voor het monitoren van de ernstige zieke patiënt opleveren en nog directere interventies mogelijk maken, zoals een vervolg op de Rotterdamse LactatE-studie(8).
Literatuur
1. Robergs Ra, Ghiasvand F, Parker D. Biochemistry of exercise-induced metabolic acidosis. am J Physiol Regul Integr comp Physiol 2004;287:R502?R516.
2. Kompanje EJ, Jansen tc, van der Hoven B, Bakker J. the first demonstration of lactic acid in human blood in shock by Johann Joseph Scherer (1814-1869) in January 1843. Intensive care Med. 2007;33:1967-1971.
3. Gladden LB. 200th anniversary of lactate research in muscle. Exerc Sport Sci Rev 2008;36:109-115.
4. De Backer D. Lactic acidosis. Intensive care Med 2003;29:699-702.
5. cohen RD, Woods HF. clinical and biochemical aspects of lactic acidosis. Blackwell
Scientific Publications; 1976.
6. Levy B, Desebbe O, Montemont c, Gibot S. Increased aerobic glycolysis through beta2 stimulation is a common mechanism involved in lactate formation during shock states. Shock 2008;30:417-421.
7. Juneja D, Singh O, Dang R. admission hyperlactatemia: causes, incidence, and impact on outcome of patients admitted in a general medical intensive care unit. J crit care 2011.
8. Jansen tc, van Bommel J, Schoonderbeek FJ, Sleeswijk Visser SJ, van der Klooster JM, Lima aP, et al. Early lactate-guided therapy in intensive care unit patients: a multicenter, open-label, randomized controlled trial. am J Respir crit care Med 2010;182:752-761.
9. Bakker J, coffernils M, Leon M, Gris P, Vincent JL. Blood lactate levels are superior to oxygen-derived variables in predicting outcome in human septic shock. chest. 1991:99(4):956-962.
10. Murphy ND, Kodakat SK, Wendon Ja, Jooste ca, Muiesan P, Rela M, et al. Liver and intestinal lactate metabolism in patients with acute hepatic failure undergoing liver transplantation. crit care Med 2001;29:2111-2118.
11. Bihari D, Gimson aE, Lindridge J, Williams R. Lactic acidosis in fulminant hepatic failure. Some aspects of pathogenesis and prognosis.J Hepatol 1985;1:405-416.
12. Luchette Fa, Jenkins Wa, Friend La, Su c, Fischer JE, James JH. Hypoxia is not the sole cause of lactate production during shock. J trauma 2002;52:415-419.
13. Kreisberg Ra, Owen Wc, Siegal aM. Ethanol-induced hyperlacticacidemia: inhibition of lactate utilization. J clin Invest 1971;50:166-174.
14. Liesivuori J, Savolainen H. Methanol and formic acid toxicity: biochemical mechanisms. Pharmacol toxicol 1991;69:157-163.
15. Fijen JW, Kemperman H, Ververs FF, Meulenbelt J. False hyperlactatemia in ethylene glycol poisoning. Intensive care Med 2006 apr;32:626-627.
16. Morshed KM, Nagpaul JP, Majumdar S, amma MK. Kinetics of oral propylene glycol- induced acute hyperlactatemia. Biochem Med Metab Biol 1989;42:87-94.
17. ter avest E, Patist FM, ter Maaten Jc, Nijsten MW. Elevated lactate during psychogenic hyperventilation. Emerg Med J 2011;28:269-73.
18. Patel Jc, Sawant MS, amin BM. Levels of lactic acid, normal level and its relation to food, glucose, cholesterol, raised blood urea and phenformin therapy. Indian J Med Sci 2000;54:21-25.
19. Miller Ra, Birnbaum MJ. an energetic tale of aMPK-independent effects of metformin. J clin Invest 2010;120:2267-2270.
20. Foretz M, Hébrard S, Leclerc J, Zarrinpashneh E, Soty M, Mithieux G, Sakamoto K, andreelli F, Viollet B. Metformin inhibits hepatic gluconeogenesis in mice indepen- dently of the LKB1/aMPK pathway via a decrease in hepatic energy state. J clin Invest 2010;120:2355-2369.
21. van Berlo-van de Laar IR, Vermeij cG, Doorenbos cJ. Metformin associated lactic acidosis: incidence and clinical correlation with metformin serum concentration measu- rements. J clin Pharm ther. 2011;36:376-382.