Meld je aan voor onze nieuwsbrief
Bij het aanmelden ga je akkoord met onze Privacy Policy
inleiding
Het proces van gaswisseling (opname van zuurstof en afgifte van koolzuur) bij het ongeboren kind vindt plaats via de placenta, postnataal gebeurt dit via de longen. Een goede functieoverdracht van placenta naar longen is dus noodzakelijk voor een ononderbroken gaswisseling. Wanneer deze functieoverdracht wordt verstoord, leidt dit tot zuurstoftekort (hypoxie), overmaat aan koolzuurgas in het bloed (hypercapnie) en een daling van de zuurgraad (acidose) bij het pasgeboren kind. Dit wordt asfyxie genoemd.(1)
Asfyxie uit zich in de huidskleur (blauw of bij ernstige vormen wit), het niet adequaat op gang komen van de ademhaling, een lage hartfrequentie, een zwakke spiertonus en het niet reageren op prikkels. Dit vertaalt zich vijf minuten postpartum in een APGAR-score van minder dan zes van de tien te behalen punten.(2)
In Nederland worden jaarlijks gemiddeld 185.000 kinderen geboren. Per jaar worden ten minste tweehonderd à terme pasgeborenen, zonder congenitale malformaties, asfyctisch geboren met een APGAR-score van vijf of minder na vijf minuten, die vervolgens vaak gereanimeerd moeten worden.(3) De prognose van deze pasgeborenen is wisselend. Na het herstel van de perinatale asfyxie kunnen in de eerste levensdagen neurologische gevolgen optreden zoals overprikkelbaarheid of hypertonie maar ook convulsies en/ of apnoe-aanvallen met cyanose. De eventuele irreversibele hersenbescha- diging kan zó ernstig zijn dat het kind alsnog overlijdt (10-60%), of in leven blijft met een ernstige handicap in de vorm van mentale retardatie en stoor- nissen in de motorische ontwikkeling (25%).(4)
Sinds 2008 wordt in Nederland the- rapeutisch koelen toegepast bij de behandeling van asfyxie bij pasgebo- renen met een zwangerschapsduur van ? 36 weken.(4) Bij deze therapie wordt binnen zes uur postpartum de centrale lichaamstemperatuur gedu- rende maximaal 72 uur gecontroleerd afgekoeld tot 33-34 °C. De pasgebo- rene wordt gedurende de therapie in een ?wrap? gelegd, een koelmatras, waardoor gekoeld water stroomt, dat rondom de romp en de benen wordt gesloten (zie Figuur 1).
Figuur 1 Therapeutisch gekoelde pasgeborene met behulp van de ?wrap?.
Het koelen van het lichaam heeft een gunstig effect op de overleving en uit- eindelijke ontwikkeling van de overle- vende pasgeborenen.(3-6) De therapie gaat echter gepaard met een aantal potentiële neveneffecten: hypotensie, obstructie van de beademingstube ten gevolge van ingedikt, plakkerig secreet, ernstige bradycardieën en een verlaagd aantal thrombocyten.(3-6) Daarnaast heeft de pasgeborene minder bewegingsvrijheid door de ?wrap?. Deze neveneffecten en de verstoorde autoregulatie van autonome functies, die na perinatale asfyxie vaak optreden, samen met de vaak gegeven kunstmatige beademingstherapie, hebben effect op het comfort van de pasgeborene.(7) De pasgeborenen krijgen daarom vaak naast anti-epileptica, ter behandeling van de convulsies, ook sedativa en/of pijnstillende medi- catie toegediend. Er zijn aanwijzingen dat therapeutisch koelen het metabolisme van een aantal geneesmiddelen, bijvoorbeeld morfine en fenobarbital, verandert. Hierdoor kan een stapeling van geneesmiddelen en geneesmiddelenmetabolieten optreden, wat kan leiden tot hoge serumspiegels en zelfs toxiciteit van geneesmiddelen.(8) Van fenobarbital is uit onderzoek bekend dat de halfwaardetijd twee keer zo lang is bij gebruik bij pasgeborenen die therapeutisch gekoeld worden ten opzichte van pasgeborenen die niet gekoeld worden.(9) Tevens kunnen geneesmiddelen (antibiotica, sedativa en anti-epileptica) door koelingstherapie mogelijk minder effectief zijn.
Voor een optimaal effect van het therapeutisch koelen is het van belang dat stress zoveel mogelijk wordt geminimaliseerd.(10) Uit een studie met pasgeboren biggen kwam naar voren dat therapeutisch koelen alleen beschermend werkt, wanneer de dieren onder narcose waren en niet wanneer zij wakker waren. Bij de biggen die therapeutisch gekoeld werden zonder narcose was de cortisolspiegel drie keer zo hoog vergeleken met biggen die bij normale temperatuur verzorgd werden.(11) Het lijkt van belang dat het niveau van stress en comfort tijdens deze therapie bij pasgeborenen bewaakt wordt en regelmatig gemeten wordt.
Een literatuurreview van Emanuelen Wielenga toonde aan dat van de bestaande COMFORT-schalen, de COMFORTneoschaal het beste meet- instrument is om stress en comfort te meten bij pasgeborenen.(12) Deze schaal vindt zijn oorsprong in de COMFORT-schaal en meet het niveau van stress en comfort aan de hand van zes gedragsitems: alertheid, kalmheid, ademhalingsreacties (of huilen), bewegen, spiertonus en gezichtsspanning (zie Tabel 1).(13) Vóór het opmaken van de score wordt een pasgeborene ge- durende twee minuten geobserveerd. De items worden gescoord middels een 5-punts Likert-schaal. De som van de afzonderlijke itemscores geeft een totaalscore (maximaal 30 punten), waarbij een hogere score meer stress betekent.

Tabel 1 De COMFORTneo-schaal.
Van Dijk keek voor de vaststelling van de klinimetrische eigenschappen van deze schaal retrospectief naar respec- tievelijk 1.149 en 2.447 COMFORTneo- scores van 286 niet en wel beademde pasgeborenen (range 24,6-42,6 weken zwangerschapsduur) en kwam tot een afkapwaarde voor wel of geen stress van veertien, bij een sensitiviteit en specificiteit van respectievelijk 0,81en 0,90.(14) De interne consistentie van de COMFORTneo-schaal was ? = 0,88 voor niet beademde en ? = 0,84 voor beademde pasgeborenen. De correla- tie tussen de COMFORTneo-schaal en de pijninschatting van de professional op een schaal van 0 tot 10 (Numeric Rating Scale ) was 0,51 (95% – BI : 0,43-0,59) (Pearson product moment correlatie coëfficiënt) en voor distress, eveneens gemeten op een schaal van 0 tot 10, 0,75 (95%-BI : 0,70-0,79).(14) Tot op heden is er geen onderzoek verricht naar de mogelijke invloed van therapeutisch koelen van pasgebore- nen met asfyxie op de score van de COMFORTneo-schaal. Met onderhavige pilot-studie wordt vastgesteld of er aanleiding is om de klinimetrische eigenschappen, diagnostische kwaliteit en het afkappunt voor stress van de COMFORTneo-schaal bij pasgeborenen tijdens therapeutisch koelen na perinatale asfyxie verder te onderzoeken.
Methoden
Design
Op de afdeling Intensive Care Neona- tologie (ICN) van het Emma Kinderziekenhuis/Academisch Medisch Centrum (EKZ/AMC) in Amsterdam werd een kwantitatieve pilot studie met een retrospectief cohort uitgevoerd. Hiervoor werden gegevens uit de patiëntenstatus gedestilleerd. Het onderzoek vond plaats vanaf april 2009, het tijdstip waarop de COMFORTneo-schaal werd geïmplementeerd, tot juli 2010.
Onderzoekspopulatie/steekproef
De onderzoekspopulatie werd gevormd door alle pasgeborenen, geboren bij een zwangerschapsduur
?36 weken, die tussen april 2009 en april 2010 opgenomen waren op de afdeling ICN van het EKZ/AMC. De onderzoekspopulatie werd, volgens de in Tabel 2 beschreven inclusiecriteria, ingedeeld in drie groepen: asfyctisch/ gekoeld (AK); asfyctisch/niet gekoeld (A) en een referentiegroep (R). Pasgeborenen die na 24 uur postpartum werden opgenomen, antenataal bekend waren met of postnataal verdacht waren voor ernstige chromosomale afwijkingen (trisomie 13 en 18, uitgezonderd trisomie 21), syndromale afwijkingen, cerebrale aanlegstoornissen, of bij wie tot 110 uur postpartum geen COMFORTneo-score was geregistreerd, werden geëxcuseerd voor deelname aan het onderzoek.

Tabel 2 Inclusiecriteria.
Ethische aspecten
Voor het onderzoek was geen toestemming nodig van de Medisch Ethische Commissie (METC). Het afnemen van de COMFORTneo-score is een onderdeel van de reguliere verpleegkundige zorg, daarom was er geen informed consent van de wettelijke vertegenwoordigers van de pasgeborenen nodig voor deelname aan dit onderzoek.
Alle verzamelde gegevens zijn vertrou- welijk behandeld en zonder vermel- ding van naam of andere persoonlijke gegevens onder een codenummer ge- analyseerd. Alleen de hoofdonderzoe- ker kon dit codenummer aan de naam koppelen. De onderzoeker heeft zich gehouden aan de eisen van de Wet Bescherming Persoonsgegevens.
Dataverzameling
Data werden verzameld over de periode vanaf nul uur (geboorte) tot 110 uur postpartum. Pasgeborenen die binnen 110 uur postpartum werden ontslagen of overleden, maar waarvan wel gegevens over de COMFORTneo- schaal beschikbaar waren, werden meegenomen in het onderzoek.
Uit de (digitale) medische en verpleegkundige patiëntendossiers werden de data, die routinematig geregistreerd werden gedurende het zorgproces, geëxtraheerd. De data van onder- staande onderzoeksvariabelen werden verzameld:
? Primaire variabelen: om de mate van stress en comfort te meten, werd de eerste COMFORTneo-score, afgenomen binnen zes uur postpartum en de eerste uit iedere daarop volgende acht uur tot maximaal 110 uur postpartum, geregistreerd (maximaal veertien scores per patiënt).
Therapeutisch koelen start maximaal zes uur postpartum. Het therapeutisch koelen duurt maximaal 72 uur. Dit wordt gevolgd door een opwarmfase van minimaal acht uur. Na de opwarmfase blijft de pasgeborene nog 24 uur in de ?wrap?. Alles bij elkaar is dit 110 uur.
– Achtergrondvariabelen: demografische patiëntkenmerken (zwangerschapsduur, gewicht, geslacht) werden verzameld om de vergelijkbaarheid van de drie groepen te beoordelen.
– Confounders: Naast het ondergaan van therapeutische koeling, kunnen het onderliggend lijden, het gebruik van sederende medicatie, het gebruik van antiepileptica, en ademhalingsondersteuning van invloed zijn op de mate van stress en comfort bij de pasgeborene. Deze parameters werden daarom geregistreerd.
Data-analyse
De verzamelde data werden geana- lyseerd met behulp van het software programma Statistical Package for the Social Sciences (SPSS) versie 17.0. De demografische gegevens zijn met behulp van beschrijvende statistiek weergegeven, gerangschikt en geordend. Voor het toetsen van het ver- band tussen categorische variabelen werd gebruik gemaakt van een Chi- kwadraat-toets.
Om groepsverschillen in COMFORT- neo te analyseren werd een Kruskal- Wallis-toets uitgevoerd. Een p-waarde < 0,05 werd beschouwd als statistisch significant. Ter correctie van statistisch significante groepsverschillen (zwangerschapsduur, kunstmatige beademing en medicatie) werd een stepwise multivariate regressie-analyse uitgevoerd.
Resultaten
Demografische en klinische gegevens
In de onderzoeksperiode werden 164 pasgeborenen geboren waarvan 134 aan de inclusiecriteria voldeden. Bij 35 pasgeborenen waren geen COMFORT- neo-scores afgenomen, waardoor 99 pasgeborenen (62 jongens) werden geïncludeerd. Elf pasgeborenen zaten in de AK-groep, vijf in de A-groep en83 in de R-groep. In totaal werden 71 pasgeborenen binnen zes uur postpar- tum opgenomen. Twee pasgeborenen van de A-groep en zestien van de R- groep werden later, maar binnen 24 uur postpartum, opgenomen. Van alle geïncludeerde pasgeborenen zijn er 46 (twee van de A-groep, 44 van de R-groep) binnen 110 uur postpartum weer ontslagen, drie van de R-groep zijn binnen 110 uur postpartum over- leden (zie Tabel 3).
Het aantal jongens per groep, AK- groep vijf, A-groep drie en R-groep 54, was niet statistisch significant verschil- lend (p=0,447). De gemiddelde zwangerschapsduur binnen de AK-groep was statistisch significant (p = 0,021) langer dan de A-groep en de R-groep, respectievelijk 40,2 weken (SD 1,2), 40,0 weken (SD 2,2) en 38,8 weken (SD 1,7). Het gemiddelde geboortegewicht was vergelijkbaar, AK-groep 3287 gram (SD 418), A-groep 3354 gram (SD 678) en R-groep 3214 gram (SD 644) (p=0,844) (zie Tabel 3).
De reden van opname voor pasge- borenen binnen de R-groep was naast problemen met het centraal zenuwstelsel (acht pasgeborenen) voornamelijk respiratoire problemen (twintig pasgeborenen) en circulatoire problemen (21 pasgeborenen). Een klein deel (acht pasgeborenen) werd opgenomen vanwege een infectie, maar het merendeel had problemen van een andere aard (26 pasgebore- nen) (zie Tabel 3). De mediaan van de APGAR-scores op tien minuten was
bij de AK-groep lager dan bij de A- groep, die van de A-groep was weer lager dan die van de R-groep, namelijk respectievelijk 4 (1-7), 7 (2-8) en 10 (6-10), dit was statistisch significant (p=0,000) (zie Tabel 3).
Gedurende de opname van de pas- geborene werden sedativa en/of anticonvulsiva indien nodig gegeven. De dosering van deze medicatie was protocollair vastgelegd. Alle pasge- borenen van de AK-groep kregen op enig moment tijdens de studie sede- rende medicatie (morfine, midazolam) en/of anticonvulsiva (fenobarbital, midazolam, clonazepam, lidocaïne),
in de A-groep waren dat twee en in de R-groep 27 pasgeborenen, deze verschillen zijn statistisch significant verschillend (p=0,000) (zie Tabel 3). Kunstmatige beademing was de meest voorkomende vorm van ademhalings- ondersteuning gedurende de studie. Alle kinderen van de AK-groep, drie van de A-groep en 30 van de R-groep werden op enig moment tijdens de studie kunstmatig beademd, dit is
een statistisch significant verschil (p=0,000) (zie Tabel 3).
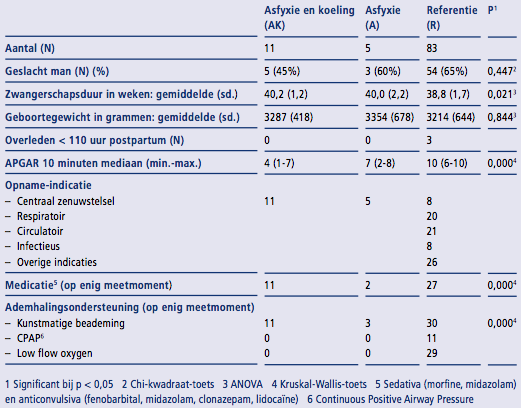
Tabel 3 Demografisch en klinische gegevens.
COMFORTneo-schaal
Van de 99 geïncludeerde pasgeborenen zijn 611 verschillende COMFORT- neo-scores vastgelegd, verdeeld over de veertien meetmomenten. De mediaan van de COMFORTneo-scores varieerde per tijdstip en per groep respectievelijk 8-10 (range 6-19, AK), 7-15 (range 6-16, A) en 10-12 (6-29, R). De scores op de veertien meetmomenten zijn weergegeven in Tabel 4.
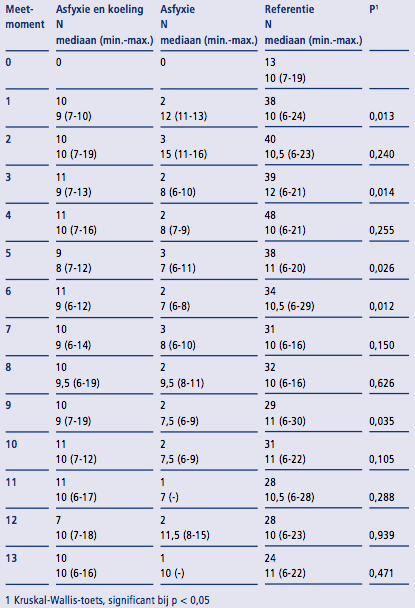
Tabel 4 COMFORTneo-score
Er was een statistisch significant verschil tussen de drie groepen op meetmoment één (p=0,013), drie (p=0,014), vijf (p=0,026), zes (p=0,012) en negen (p = 0,035). Het verloop van de mediane score per groep in de tijd is weergegeven in (zie Figuur 2). De gemiddelde COMFORTneo-score per kind gedurende de inclusieperiode verschilde per groep respectievelijk AK 9,79 (SD 1,31 range 7,7 – 12,0), A 11,02 (SD 3,28 range 6,9-15,6) en R 11,49 (SD 2,85 range 6,7 – 25,0). Deze verschillen zijn echter niet statistisch significant (p = 0,071)
De correctie van statistisch significante groepsverschillen (zwangerschaps-duur, APGAR-score en kunstmatige beademing en medicatie) met behulp van multivariate regressie-analyse bleek niet mogelijk omdat data niet voldeden aan de voorwaarden (te veel variatie in een te kleine groep) voor het uitvoeren van een dergelijke analyse.
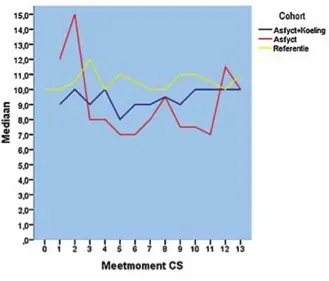
Figuur 2 COMFORTneo-score.
Discussie
De resultaten van dit onderzoek tonen geen groot verschil in hoogte van COMFORTneo-scores tussen de drie groepen. Er is echter wel een trend te zien in lagere mediane scores op de COMFORTneo-schaal van de AK-groep ten opzichte van de R-groep. Op een aantal meetmomenten is dit verschil zelfs statistisch significant. Ook de mediane COMFORTneo-score van de A-groep ligt op de meeste meetmo- menten lager dan de R-groep en zelfs lager dan de AK-groep. De A-groep bestond echter maximaal uit drie pasgeborenen per meetmoment en is derhalve niet representatief.
Het resultaat van deze pilot-studie roept de vraag op hoe verklaard kan worden dat de scores van de A-groep over het algemeen lager liggen dan die van de AK-groep. De verwachting vooraf was dat de scores van de AK- groep het laagst zouden zijn doordat, naast het gebruik van sedativa (voor het neurologisch lijden en de beademingsafhankelijkheid), bij deze pasgeborenen ten gevolge van de wrap een bewegingsbeperking ontstond. Beweging is immers een item op de COMFORTneo-schaal. Zoals al eerder gemeld, is de groepsgrootte van de A-groep mogelijk een verklaring voor het niet optreden van deze verwachte verschillen.
Het verschil tussen de scores van de R- groep en de AK-groep wordt mogelijk veroorzaakt door het verschil in neurologisch lijden, maar zou ook te verklaren zijn uit de verschillen in ademhalingsondersteuning (minder beademing in de R-groep), medicatiegebruik (minder sedativa en anticonvulsiva in de R-groep) en meer bewegingsmogelijkheden voor de R-groep door het ontbreken van het therapeutisch koelen en de daarbij gebruikte wrap.
Wat betreft de demografische gegevens waren de groepen meestal wel overeenkomstig. De zwangerschapsduur was wel significant verschillend maar de verschillen waren zeer klein en waarschijnlijk niet van invloed op de mogelijkheid van de pasgeborenen om stresssignalen af te geven die gemeten worden met de COMFORTneo-schaal. De verschillen in zwangerschapsduur lijken klinisch niet relevant.
De gevonden significante verschillen in de APGAR-scores zijn een logisch gevolg van de groepsindeling. Een teken van asfyxie is namelijk een lage APGAR-score en vormde als zodanig een inclusiecriterium voor de AK groep. Daarnaast kan een lage APGAR-score een aanwijzing zijn voor potentieel neurologische schade en daarmee de mogelijkheden van pasgeborenen om stress en comfort te uiten beïnvloeden. De analyse naar de relatie tussen de gevonden significante verschillen in COMFORTneo-scores tussen de groepen wees uit dat deze voor een deel toe te schrijven zijn aan de ongelijkheid in APGAR-scores tussen de groepen.
De gegeven sedativa en/of anticonvulsiva en de mate van ademhalingsondersteuning vond plaats op basis van individuele beslissing van de arts en de klinische toestand van de pasgeborenen en niet protocollair. De variatie was daardoor groot en de invloed op de COMFORTneo-score in deze retrospectieve pilot-studie kon niet nader worden geanalyseerd.
Het routinematig scoren van stress met de COMFORTneo-schaal alsook het behandelen van pasgeborenen met therapeutische koeling na perinatale asfyxie zijn pas in april 2009 van start gegaan op de afdeling ICN van het EKZ/AMC. Er moet mogelijk rekening gehouden worden met een zogenaamde learning curve gedurende de periode waarin de data voor deze stu- die verzameld werden. Dit zou effect kunnen hebben op de consciëntieusheid van verpleegkundigen in het uitvoeren van de COMFORTneo-scores. In dit onderzoek heeft dat geleid tot een groot aantal ontbrekende waarden waarvoor geen vervangende waarden geïmputeerd konden worden. Een meting van stress is namelijk een momentopname en laat zich niet ver- vangen door vervangende waarden.(15) In toekomstig prospectief onderzoek zou dit een punt van aandacht moeten zijn.
Daarnaast was er, gezien het retrospectieve karakter van de studie, geen sprake van een gestandaardiseerde wijze en tijdstip van het opmaken van de COMFORTneo-score. Zo waren er geen vaste tijdstippen waarop de metingen werden uitgevoerd, maar werd de keuze voor het tijdstip van de meting door de verpleegkundige bepaald. Er zijn uit de literatuur geen COM- FORTneo-scores bekend van pasge- borenen met asfyxie zonder therapeutisch koelen. Het gebruik van de COMFORTneo-schaal en therapeutisch koelen zijn in Nederland vrijwel gelijktijdig ingevoerd. Er is in Nederland veel bekendheid gegeven aan de implementatie van het therapeutisch koelen, daardoor zijn er nu nog maar weinig pasgeborenen die deze behan- deling mislopen door bijvoorbeeld het te laat verwijzen vanuit een perifeer ziekenhuis. De COMFORTneo-scores van ongekoelde asfyctische pasgeborenen kunnen alleen verkregen worden door landelijk de scores prospectief gedurende langere tijd te verzamelen. Deze pilot-studie was een eerste stap in het verkrijgen van inzicht in deze materie. Therapeutisch koelen heeft effect op de fysiologische respons van een pasgeborene. Verschillende studies hebben aangetoond dat er een verandering optreedt in zowel de hartfrequentie als de bloeddruk.(16-18) De COMFORTneo-schaal is een gedragsschaal en meet geen fysiologische items. De oorspronkelijke COMFORT- schaal daarentegen meet naast de zes
gedragsitems ook twee fysiologische items: bloeddruk en hartfrequentie.(13) Bij pasgeborenen die therapeutisch gekoeld worden zou in overweging genomen kunnen worden de oorspronkelijke COMFORT-schaal te ge- bruiken (of de beide items naast de COMFORTneo-score te verzamelen en te analyseren).
In toekomstig onderzoek zou de meerwaarde van de fysiologische items bestudeerd moeten worden. Het is wenselijk de uitkomsten van de COMFORT-neo schaal op itemniveau van therapeutisch gekoelde pasge- borenen te vergelijken met die van niet-therapeutisch gekoelde pasgeborenen. Daarnaast is een vergelijk met een andere standaard (bijvoorbeeld een biochemische marker van stress zoals cortisol, of met een meting van de huidgeleiding) wenselijk.(19)
Er moet nauwkeurig gekeken worden naar de klinimetrische eigenschappen van de COMFORTneo-schaal en het afkappunt voor deze specifieke groep pasgeborenen. De effecten van beïnvloedende factoren, zoals medicatie, onderliggend lijden (neurologische schade) en ademhalingsondersteuning op de hoogte van de score moeten tevens systematisch onderzocht worden. Vervolgonderzoek zou eenduidig moeten zijn in
het tijdstip en de frequentie van het meten de COMFORTneo-score.
Conclusie en aanbevelingen
Door genoemde tekortkomingen van deze pilot-studie kunnen er geen harde uitspraken gedaan worden over de COMFORTneo-schaal bij gekoelde asfyctische pasgeboren. Er lijken voldoende aanwijzingen te zijn voor vervolgonderzoek naar de klinimetrische eigenschappen en het wenselijke afkappunt voor stress. Dit moet gezien de lage incidentie van therapeutisch koelen, plaatsvinden met een nationale prospectieve studie.
Verder is het wenselijk de uitkomsten van de COMFORTneo-score op itemniveau te bestuderen om zo de verschillen in stressopbouw vast te stellen. Het is belangrijk om een betrouwbaar inzicht te hebben in de mate van stress tijdens therapeutische koeling na perinatale asfyxie want meten is weten en gissen is missen.

literatuur
1. Brande Jl van den, heymans hAS, Monnens lAh. (1998). kindergeneeskunde. Elsevier gezondheids- zorg: Maarssen.
2. Eyskens E, Feentra l, Meinders AE, Vandenbroucke Jp. (2001). Codex Medicus. Elsevier: Arnhem.
3. groenendaal F, Brouwer AJ. Clinical aspects of induced hypothermia in full term neonates with perinatal asphyxia. Early hum Dev 2009; 85(2):73-6.
4. Jacobs S, hunt R, Tarnow-Mordi W, Inder T, Davis p. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Systematic Review 2007; 17(4):CD003311.
5. polderman kh, herold I. Therapeutic hypothermia and controlled normothermia in the intensive care unit: practical consideration, side effects, and cooling methods. Crit Care Med 2009; 37(3):1172-3.
6. Schulzke SM, Rao S, patole Sk. A systematic review of cooling for neuroprotection in neonates with pypoxic ischemic encephalopathy ? are we there yet? BMC pediatrics, 2007; 7:30.
7. pryds O, greisen g, lou h, Friis-hansen B. Vasopa- ralysis associated with brain damage in asphyxiated term infants. J pediatr 1990; 117:119-25.
8. Róka A, Melinda kT, Vásárhelyi B, Machay T, Azzopardi D, Szabó M. Elevated morphine concentrations in neonates treated with morphine and prolonged hypothermia for hypoxic ischemic encephalopathy. pediatrics 2008; 121(4):e844-9.
9 Thoresen M, Stone J, hoem NO, et al. hypothermia after perinatal asphyxia more than doubles the plasma half-life of phenobarbitone. pediatr Res 2003; 53:p.24A.
10. Thoresen M, Whitelaw A. Therapeutic hypothermia for hypoxic-ischaemic encephalopathy in the new- born infant. Curr Opin Neurol 2005; 18:111-16.
11. Thoresen M, Satas S, loberg EM, Whitelaw A, et al. Twenty-four hours of mild hypothermia in unse- dated newborn pigs starting after a severe global hypoxic-ischemic insult is not neuroprotective. pedi- atr Res 2001; 50:405-411.
12. Emanuel DhM, Wielenga JM. COMFORT-schaal bij pasgeborenen: een review. Verpleegkunde 2010; 25(2):12-19.
13. Ambuel B, hamlett kW, Marx CM, Blumer Jl. Asses- sing distress in pediatric intensive care environ- ments: the COMFORT scale. J pediatr psychol 1992; 17(1):95-109.
14. Van Dijk M, Roofthooft DWE, Anand kJS, gulde- mond F, et al. Taking up the challenge of measuring prolonged pain in (premature) neonates. The COM- FORTneo scale seems promising. Clin J pain 2009; 25:607-616.
15. Engels JM, Diehr p. Imputation of missing lon- gitudinal data: a comparison of methods. J Clin Epidemiol 2003; 56:968-976.
16. gunn AJ, gluckman pD, gunn TR. Selective head cooling in newborn infants after perinatal asphyxia: a safety study. pediatrics 1998; 102:885-92.
17. gluckman pD, Wyatt JS, Azzopardi D, Ballard R, et al. Selective head cooling with mild systematic hypothermia after neonatal encephalopathy: multicentre randomised trial. lancet 2005; 365(9460):663-70.
18. Shankaran S, laptook AR, Ehrenkranz RA, Tyson JE, et al.; National Institute of Child health and human Development Neonatal Research Network. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med 2005; 353(15):1574-84.
19. Eriksson M, Storm h, Fremming A, Schollin J. Skin conductance compared to a combined behavioural and physiological pain measure in newborn infants. Acta paediatr 2008;97(1):27-30.






