Meld je aan voor onze nieuwsbrief
Bij het aanmelden ga je akkoord met onze Privacy Policy
De bijsluiter
Elke infuusvloeistof heeft een bijsluiter, maar die zit niet bij elke zak. Gelukkig staat er wel veel informatie op de zak zelf. Voor het gemak is die voor veel van de in Nederland beschikbare infuusvloeistoffen ook in Tabel 1 gezet. Kijk de komende tijd eens naar de kleine lettertjes op de zak die je aanhangt. Die zijn cruciaal om werking en bijwerkingen te begrijpen.
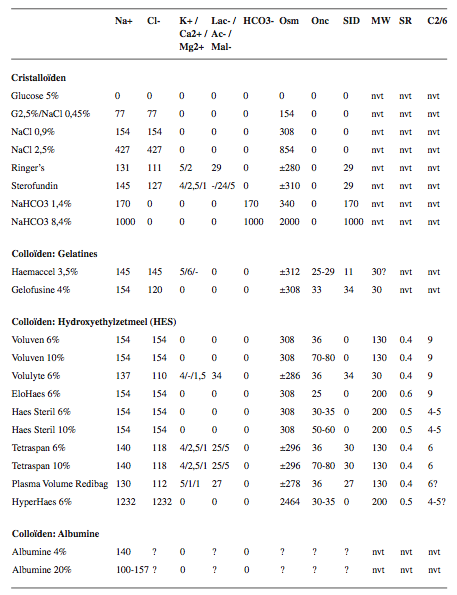
Tabel 1.
Samenstelling en eigenschappen van een groot aantal in Nederland beschikbare infuusvloeistoffen. Lac-, lactaat; Ac-, Acetaat; Mal-, Malaat; Osm, Osmolariteit (mOsm/L); Onc, Oncotische druk (mm Hg); SID, Strong Ion Difference; MW, Molecular Weight, molecuulgewicht; SR, Substitutieratio; C2/6, C2/C6 ratio; Nvt, Niet van Toepassing; ?, onbekend of dubieus.
Het doel van vulling
Hemodynamisch instabiel betekent dat er een probleem is met het aanbod van zuurstof aan de cellen en weefsels. Het uiteindelijke doel van vulling is dan ook om dit zuurstofaanbod te verbeteren. Maar in praktijk is het zuurstofaanbod lastig meetbaar. Er bestaan geavanceerde technieken om de bloedstroom tot in de microcirculatie te vervolgen. Bijvoorbeeld SdF-imaging waar capillairen mee gefilmd kunnen worden. Maar deze technieken hebben beperkingen en zijn vaak niet beschikbaar in de acute fase van resuscitatie. Daarom wordt vaak een inschatting gemaakt van het zuurstofaanbod op basis van globale hemodynamische parameters. Het doel van vullen wordt daarmee het optimaliseren van deze para-meters. We weten dat het zuurstoftransport afhankelijk is van de cardiac output, het hemoglobine en de arteriële saturatie. Maar vaak moeten we het doen met hartfrequentie, bloeddruk en perifere saturatie. Het doel van vullen wordt daardoor meestal het optimaliseren van de bloeddruk. Dat is niet altijd een slechte gedachte, hoewel er veel mitsen en maren zijn zoals hieronder uiteengezet zal worden.
Frank en Starling
Dat vulling de cardiac output kan verbeteren is al bekend sinds het begin van de vorige eeuw. Het slagvolume van het hart neem toe naarmate het meer gevuld is juist voor het begin van de slag. Het slagvolume is dus afhankelijk van het eind-diastolisch volume. Dit komt omdat een spiervezel meer kracht kan ontwikkelen naarmate die bij het begin van de contractie meer uitgerekt is. Otto Frank en ernest Starling hebben uiteindelijk hun naam geleend aan dit verschijnsel. Maar er zijn grenzen aan dit fenomeen. op een bepaald moment zal de cardiac output niet verder toenemen, of zelfs afnemen. Het lastige is dat er grote individuele verschillen zijn tussen de mate van extra volume en de mate van toename van de cardiac output. Bij patiënten met hartfalen zal die grens bijvoorbeeld sneller bereikt zijn.
Hemodilutie
Het is belangrijk om je te realiseren dat zuurstof erg slecht oplosbaar is in plasma. Het hemoglobine is dus bijna helemaal verantwoordelijk voor het zuurstoftransport. Stel dat je door vulling het intravasculair volume met 10% vergroot, dan betekent dit ook een afname van de hemoglobine concentratie met 10%. Simpel gezegd betekent dit dat de cardiac output dan met minstens 10% zal moeten toenemen om iets nuttigs te doen.
Meten van de opbrengst
In praktijk is het niet eenvoudig te bepalen hoeveel vulling een patiënt nodig heeft. Soms wordt hierbij gekeken naar de centraal veneuze druk. Maar deze druk zegt weinig over volume. En de druk in het rechteratrium zegt al helemaal weinig over het volume in het linkerventrikel. De oplossing hiervoor is de volume challenge. Daarbij wordt snel 250- 500 cc infuusvloeistof toegediend en gekeken naar de respons. Dit kan overigens ook middels passive leg raising door het bed te kantelen zodat de benen opgetild worden waardoor er een autotransfusie richting het hart plaatsvindt. Uiteraard moet niet verder worden gevuld als daar geen noodzaak voor is. Dat wil zeggen in het geval dat klinisch en getalsmatig er geen reden is om aan te nemen dat er hemodynamische instabiliteit is of als een volume challenge geen opbrengst meer geeft. Maar op welke parameter wordt een succesvolle volume challenge beoordeeld? Idealiter zouden we een verandering in het zuurstofaanbod in microcirculatie moeten meten, maar zoals eerder opgemerkt is dat tot nu toe nauwelijks mogelijk. Een alternatief is het meten van de gemengd of centraal veneuze saturatie, waarmee bekeken kan worden of de lichaamsbalans tussen zuurstofopname en verbruik verbetert. Of we kunnen kijken naar het verschil in cardiac output. Dit laatste verklaart mogelijk dat de Swan ganz katheter weer enigszins in de gratie komt. Maar cardiac output kan natuurlijk ook gemeten worden met minder invasieve methodes zoals polscontouranalyse.
Dynamische indices van preload
Niet bij iedere patiënt wordt de cardiac output gemeten. Dan zouden we kunnen varen op een verandering in de arteriële bloeddruk. Maar daarmee gaan we ervan uit dat de perifere vaatweerstand bij patiënten constant is. En dat is een gevaarlijke aanname doordat in het tijdsbeloop van ziekte en behandeling endogene en toegediende vasopressoren de vaatweerstand erg kunnen beïnvloeden. Een andere manier om de vullingstoestand te beoordelen is door gebruik te maken van zogenaamde dynamische indices van preload. Dit zijn bijvoorbeeld de slagvolumevariatie, systolic pressure variation of pulse pressure variation. Hierbij wordt gekeken naar de verschillen in respectievelijk slagvolume, systolische bloeddruk en de systolische minus de diastolische bloeddruk gedurende de beademingscyclus. Bij een ondervulde patiënt heeft beademing namelijk een grote invloed op de veneuze return en daarmee op de genoemde indices. De afkapwaarden van deze indices liggen zo rond de 10%. Als ze hoger zijn, pleit dat voor vloeistoftherapie. Een inherent probleem is natuurlijk dat dit alleen gevalideerd is voor beademde patiënten met een groot teugvolume (> 8 ml/kg) en zonder ritmestoornissen.
Waar blijft die infuusvloeistof?
Water draagt voor ongeveer 60% bij aan het lichaamsgewicht. Met andere woorden: iemand van 70 kg heeft ongeveer 42 liter water aan boord. Dat is verdeeld over drie compartimenten: intravasculair, interstitieel en intracellulair (Figuur 1). De grens tussen het intracellulaire en interstitiële compartiment is lek. Water kan erg makkelijk de cel in en uit. Toch is er hier normaal gesproken geen netto transport van water. dat komt omdat de hoeveelheid opgeloste deeltjes, oftewel de osmolariteit in elk compartiment gelijk is. Zodra dat niet zo is zal water bewegen en het verschil in osmolariteit snel opheffen. De eenheid van osmolariteit is milliosmol, of mosm. Maar je kunt ook spreken over osmotische druk. De normale osmolariteit van de compartimenten is ongeveer 290 mosm/l. Dat komt overeen met een druk van 5000 mmHg. Maar doordat de osmolariteit in alle compartimenten normaal gesproken hetzelfde is, vindt er geen netto vloeistoftransport plaats. De grens tussen het intravasculaire en interstitiele compartiment is ook lek. Zowel water als ionen kunnen hier makkelijk passeren. Daarnaast beweegt de bloeddruk in de capillairen vloeistof richting het interstitium. Ook in de bloedbaan is de osmolariteit ongeveer 290 mosm/l. Zowel in het interstitiële als intravasculaire compartiment wordt de osmolariteit voor meer dan 99% bepaald door ionen. Maar omdat deze ionen vrij doorlaatbaar zijn, spelen ze geen rol bij osmose. De eiwitten wel. De belangrijkste daarvan is het intravasculaire albumine. Dit is te groot om de grens tussen capillair en interstitium te passeren. Ondanks dat het maar ongeveer een 0,5% van de osmalariteit vormt is het daarom heel belangrijk. Deze zogenaamde oncotische druk gaat namelijk de extravasatie door de bloeddruk in de capillairen tegen. Beide zijn gemiddeld ongeveer 25 mmHg.
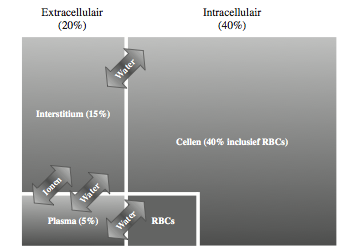
Figuur 1. Schematische voorstelling van de verschillende compartimenten in het menselijk lichaam. De compartimentsgrenzen zijn makkelijk doorgan- kelijk voor water. Ionen kunnen alleen de grens tussen interstitium en plasma makkelijk passeren. RBCs, Red Blood Cells, rode bloedcellen.
Vloeistoftherapie en osmolariteit
Door vloeistoftherapie kan de osmolariteit van plasma en interstitium veranderen. Dat leidt tot watertransport zodat de osmolariteit weer overal gelijk is. De osmolariteit van plasma en infuusvloeistoffen is makkelijk te benaderen door de belangrijkste ionen bij elkaar op te tellen. Voor normaal plasma is dit dus ongeveer 290 mosm/l. In Tabel 1 wordt de osmolariteit van verschillende infuusvloeistoffen weergegeven.
Cristalloïden
De ionen uit cristalloïden verdelen zich over plasma en interstitium, omdat de grens tussen die compartimenten voor ionen doorlaatbaar is. dat duurt ongeveer een half uur. Als de infuusvloeistof ongeveer dezelfde osmolariteit had als de patiënt, zal het vocht zich dus ook verdelen over plasma en interstitium. Dat betekent dat het infunderen van 1 liter naCl 0,9%, met een osmolariteit van ongeveer 308 mosm, zal leiden tot een toename van het plasmavolume met 0,25 l en toename van het interstitieel volume met 0,75 l. Dit betekent dat er 4 liter naCl 0,9% moet worden gegeven om het plasmavolume met 1 liter te laten toenemen. Als de infuusvloeistof een lagere osmolariteit heeft zullen interstitium en plasma dat ook krijgen en zal water zich verplaatsen naar intracellulair. Het infunderen van 1 liter glucose 5% is een goed voorbeeld. de effectieve osmolariteit is 0 mosm/l, omdat het glucose de cel in gaat en wordt gemetaboliseerd. Uiteindelijk leidt dat tot een toename van het intracellulair volume met 0,67 l, van het interstitium met 0,25 liter en slechts 0,08 liter blijft in de bloedbaan. Dit betekent dat er maar liefst 12 liter glucose 5% moet worden gegeven om het plasmavolume met 1 liter te laten toenemen. Hyperosmolaire oplossingen zullen juist water uit de cel trekken.
Colloïden
Uit Tabel 1 blijkt dat alle colloïden opgelost zijn in zoutoplossingen. Net als bij de cristalloïden zullen de ionen hierin zich uiteindelijk verdelen over plasma en interstitium. De ionen bepalen ook bij deze oplossingen de osmolariteit van de infuusvloeistof. Het verschil is dat er ook grotere moleculen in deze infuusvloeistoffen zitten. Die kunnen de vaatwand niet passeren. Ondanks dat ze in veel kleinere aantallen opgelost zijn dan de ionen, is het effect van deze moleculen groot. Door hun zogenaamde colloïd osmotische druk houden ze het vocht in de bloedbaan. Dit is echter een tijdelijk effect, want de grote moleculen worden afgebroken, zodat uiteindelijk de zoutoplossing overblijft. Hoe lang het duurt voordat deze moleculen worden afgebroken hangt af van de samenstelling van het colloïd. Er zijn grofweg 4 soorten colloïden: dextranen, gelatines, hydroxyethyzetmelen en albumine. Dextranen zijn niet meer verkrijgbaar in Nederland en zullen niet worden besproken. Gelatines worden bereid uit rundercollageen, dat in kleine stukjes wordt gesplitst. die stukjes worden door crosslinks weer tot grotere moleculen gesmeed. dit kan met ureum en met succinyl. Het molecuulgewicht is ongeveer 30kda. Dat betekent dat het relatief makkelijk gefiltreerd wordt door de nier, maar er is wel een tijdelijk volume-effect. Gelatines worden door amylase in kleinere stukjes gesplitst. Hydroxyethyeelzetmelen (HeS) worden gemaakt uit mais of aardappelzetmeel. Bij de bereiding wordt op sommige plekken moleculen vervangen door een zogenaamde hydroxyehtylgroep. Dit kan op verschillende plekken, onder andere op elk tweede en zesde koolstofatoom in het zetmeel. Ook HeS wordt afgebroken in kleinere stukjes door amylase en renaal uitgescheiden. Hoe snel dat gaat is afhankelijk van een drietal zaken. Allereerst is er het molecuulgewicht. Hoe groter, hoe langer het duurt voordat de stukjes klein genoeg zijn om in de urine te belanden. In de tweede plaats in de substitutieratio belangrijk.
Hoe meer hydroxyethylgroepen het zetmeel bevat, hoe langer het duurt voordat het afgebroken is. Tot slot is het zo dat HeS sneller wordt afgebroken als de hydroxyethylgroepen vooral op de 6de koolstomatomen zitten(c6) dan als deze vooral op de tweede koolstofatomen zitten (C2). Dat wordt uitgedrukt als C2/C6 ratio. Hoe hoger die is, hoe langer het duurt voordat HeS de bloedbaan uit is. Albumine is het lichaamseigen colloïd en heeft theoretisch een groot aantal voordelen. Zo transporteert het een groot aantal moleculen waaronder vitamine d, cortisol, en antibiotica. Ook heeft het anti-oxidatieve eigenschappen en rekruteert het de microcirculatie. Het wordt steeds duidelijker dat isotoon albumine een gunstige keuze is voor vloeistoftherapie bij patiënten met sepsis. Er is hierover echter nog veel discussie en het zou goed kunnen dat gesuppleerd albumine andere eigenschappen heeft dan het eigen albumine.
Bij sepsis is er wel vaak sprake van een zogenaamd capillair lek. Dat houdt in dat ook grotere moleculen de vaatwand kunnen passeren. Dat betekent dat colloïden mogelijk sneller de bloedbaan verlaten en zich kunnen ophopen in het interstitium.
Anafylaxie
Colloïden zijn geassocieerd met allergische reacties. Deze komen het meeste voor bij ureum gelinkt gelatine in mindere mate bij dextranen, albumine en hydroxyethylzetmelen. De incidentie van ernstige anafylactische reacties is voor ureum gelinkt gelatine ongeveer 0.3 procent en voor de overige colloïden grofweg een factor 10 lager.
Te veel vullen
Zoals inmiddels duidelijk is blijft niet al het vocht in de bloedbaan. Behalve dat de cardiac output dus op een gegeven moment niet meer toeneemt of zelfs afneemt bij overvulling, leidt dit dus ook tot ophoping van vocht. Het meest bekende voorbeeld daarvan is natuurlijk pulmonaal oedeem, dat leidt tot respiratoire insufficiëntie. Maar oedeem op alle andere plekken kan ook desastreus zijn voor het zuurstofaanbod aan de cellen. Door het oedeem komen die cellen namelijk verder af te staan van de capillairen die ze van zuurstof moeten voorzien.
Van vullen wordt je zuur
Om te begrijpen wat de invloed is van vloeistoftherapie op het zuur-base evenwicht is het makkelijk om dit te benaderen met de methode Stewart. Een volledige behandeling van deze aanpak valt buiten het terrein van dit artikel maar is te vinden op de website www.acidbase.org.
Een van de belangrijkste punten van de methode is dat bicarbonaat geen invloed heeft op het zuur-base evenwicht. naast de PCo2 zijn er slechts twee zaken die de [H+] concentratie en dus de pH bepalen. Dit zijn de totale hoeveelheid zwak zuur (Atot) en het zogenaamde Strong Ion difference (SId). Het belangrijkste zwakke zuur is albumine. Toediening daarvan heeft dus een verzurende invloed. Alle andere infuusvloeistoffen verdunnen de hoeveelheid albumine en zijn daardoor alkaliniserend.
Maar dit wordt vaak teniet gedaan door de grotere invloed van het SId. SId is het verschil tussen sterke positief geladen ionen en de sterke negatief geladen ionen. In het lichaam zijn natrium en chloride daarvan de belangrijkste componenten. Als de SId lager wordt door toediening van een infuusvloeistof is dat verzurend en andersom alkaliniserend. Een simpele berekening laat zien dat een normale SId in de mens ongeveer 40 mM is (140 mM na+ minus 100 mM Cl- = 40 mM SId). Ook de SId van infuusvloeistoffen kan op die manier vereenvoudigd worden uitgerekend. Voor het gemak is de SId van verschillende infuusvloeistoffen ook opgenomen in Tabel 1. Als de SId van een infuusvloeistof lager is dan die van de patiënt, zal de SId in de patiënt uiteraard afnemen. Zo is het eenvoudig om te zien dat bijvoorbeeld naCl 0,9% of colloïden opgelost in naCl 0,9% verzurender zijn dan de zogenaamde gebalanceerde infuusvloeistoffen zoals ringer?s en volulyte. Als acidose een probleem is bij een patiënt, is er wat te zeggen voor gebalanceerde infuusvloeistoffen.
Vullen en stollen
Alle infuusvloeistoffen hebben invloed op de stolling. Dit komt enerzijds door verdunning van de stollingsfactoren. Anderzijds is het zo dat als de pH lager wordt, de stolling slechter wordt. dus zullen infuusvloeistoffen met een lage [SId] een negatief effect op de coagulatie uitoefenen.
Een speciaal geval vormen de colloïden. Deze beïnvloeden de stolling op vele manieren. Bij hele kleine hoeveelheden hebben ze een stollingsbevorderende werking. Maar over het algemeen overheerst het negatieve effect op de stolling. Dit is het meest uitgesproken bij de HeS met hoog molecuulgewicht. Als de stolling in het geding is, lijkt vullen met gebalanceerd crystalloiden dus de meest rationele keuze.
Vullen en de nier
Vullen kan een gunstig effect op de nierfunctie hebben als door vulling de cardiac output toeneemt, de bloedviscositeit afneemt en hierdoor de nierperfusie toeneemt. Belangrijk is trouwens dat een toename van de diurese niet automatisch betekent dat de nierfunctie beter wordt. Er is veel discussie over een mogelijk ongunstig effect van vloeistoftherapie op de nierfunctie. Colloïden kunnen osmotische schade in de proximale tubulus geven. Daarnaast zijn er aanwijzingen dat colloïden zich kunnen ophopen in nierweefsel. Alle infuusvloeistoffen kunnen overigens de nierperfusie verminderen als er meer oedeem ontstaat.
Nierschade door colloïden bij sepsis
De vele studies over dit onderwerp hebben verschillende tekortkomingen en zijn moeilijk te interpreteren. Maar in het algemeen kan gesteld worden dat colloïden wel degelijk de nierfunctie kunnen verslechteren. Met name bij patiënten met sepsis en patiënten met een reeds verslechterde nierfunctie. Dit is met name bewezen voor dextranen en hoogmoleculaire hydroxyehthylzetmelen, met name als ze ook hyperoncotisch zijn, dus bijvoorbeeld de 10% oplossingen. Minder bewijs is er voor albumine, gelatine en de laagmoleculaire en minder hyperoncotische hydroxyethylzet- melen, zoals bijvoorbeeld HeS 130/0.4. Maar ook voor deze oplossingen is het momenteel niet mogelijk te stellen dat ze bij septische patiënten zeker veilig zijn voor de nier. Sterker nog, er zijn zeer recente aanwijzingen dat dit niet zo is. Bij patiënten met sepsis lijken synthetische en hyperoncotische colloïden dus een minder goede keuze.
Geen bewijzen
Gedurende de laatste 50 jaar is er heel veel discussie over welke vloeistof onder welke omstandigheden in welke patiëntengroep de beste is. Die discussie duurt vooral al zo lang omdat veel trials geen verschil in mortaliteit laten zien. En op de trials die dat wel doen is de nodige kritiek. Er is zeker de laatste tijd een tendens tegen colloïden. Dit komt omdat ze duurder zijn, meer bijwerkingen hebben, klinisch niet zoveel volumebesparend zijn ten opzichte van cristalloïden als zou mogen worden verwacht en geen bewezen overlevingsvoordeel hebben boven cristalloïden. Daar komt bij dat recent een groot aantal publicaties van een gerenommeerd onderzoeker op dit gebied zijn teruggetrokken wegens vermeende fraude. Dat maakt de interpretatie van dit vakgebied niet eenvoudiger.
Conclusie
Infuusvloeistoffen zijn geneesmiddelen. Met bijwerkingen. Dat betekent dat bewuste keuzes gemaakt moeten worden over de soort en hoeveelheid infuusvloeistof die wordt gegeven. Studies geven tot nu toe nog steeds te weinig houvast om op basis van harde uitkomsten te kunnen kiezen. Maar daarom is keuzes maken op basis van de fysiologie en pathofysiologie des te belangrijker. Per situatie en per patiënt moet dan bekeken worden wat het beste is. Niet te veel en niet te weinig van het juiste middel. En dat betekent: lees het label en laat je leiden door onderstaande suggesties.
Suggesties
1. het doel van vloeistoftherapie is om een vochttekort aan te vullen en de doorbloeding van organen en hiermee het zuurstofaanbod te verbeteren;
2. als je vloeistoffen geeft dan moet je – zo goed en zo kwaad als dit kan – controleren of je dit doel bereikt of misschien juist niet;
3. als bij een slecht gecirculeerde patiënt met vulling de cardiac output, de veneuze saturatie en de microcirculatie verbeteren dan doe je iets goeds voor de patiënt;
4. een afname van dynamische vullingsparameters, zoals de slagvolumevariatie, systolische druk variatie of de polsdruk variatie is ook een goed teken, maar deze zijn alleen bruikbaar als er geen ritmestoornissen zijn en als de patiënt met grote teugvolumes wordt beademd;
5. alle infuusvloeistoffen verlaten in ieder geval gedeeltelijk de bloedbaan. de mate waarin en de snelheid waarmee dit gebeurt hangt af van de samenstelling van de toegediende vloeistof;
6. als vloeistoftherapie tot meer oedeem leidt, kan dit schadelijk zijn voor het zuurstofaanbod aan de weefsels en dus voor de patiënt;
7. vloeistoffen beïnvloeden de pH. Vloeistoffen met een lage SId zoals naCl 0.9% maken het lichaam zuur en vloeistoffen met een SId in de fysiologische range, zoals ringer?s, zijn meer pH neutraal;
8. als acidose een probleem is bij een patiënt, is er wat te zeggen voor gebalanceerde infuusvloeistoffen;
9. alle infuusvloeistoffen beïnvloeden de stolling negatief, maar gebelanceerde cristalloïden het minst. daarom is dat de meest rationele keuze als de stolling in het geding is.
10. bij patiënten met sepsis lijkt isotoon abumine het veiligste colloïd en zijn synthetische en hyperoncotische colloïden mogelijk schadelijk voor de nier.