Meld je aan voor onze nieuwsbrief
Bij het aanmelden ga je akkoord met onze Privacy Policy
Introductie
Verschillende onderzoeken hebben aangetoond, dat bedlegerigheid en inactiviteit bij ernstig zieke patiënten resulteert in fysieke achteruitgang en functieverlies van het bewegingsapparaat. Longontsteking, spieratrofie, vermindering van de bewegingscoördinatie, osteoporose, slechte circulatie, decubitus en contracturen zijn negatieve gevolgen van langdurige bedrust.(1-2) Een manier om deze fysieke achter- uitgang tegen te gaan is mobiliseren. In de meeste ziekenhuizen is dit ook gangbare praktijk geworden.(3)
Bij patiënten op de intensive care (IC) ondervindt dit beleid echter obstakels. Nog niet zo lang geleden was het standaard om pas aan het einde van de IC-periode te beginnen met het mobiliseren van de IC-patiënt. De huidige tendens is om hiermee in een vroeger stadium te starten (vroeg-mobiliseren). Een aantal onderzoeken heeft laten zien dat vroeg-mobiliseren een positief effect heeft op functioneel bewegen en spierkracht, maar ook op beademingsduur, IC-ligduur en duur van de gehele ziekenhuisopname.(4-7) In de praktijk blijkt het echter moeilijk om het juiste moment van vroeg-mobilisatie en de juiste trainingsprikkel op de individuele IC-patiënt af te stemmen. Oorzaken hiervan zijn de ernst van de ziekte, de snel wisselende actuele situatie en conditie van de patiënt, de verschillende doelen die door diverse dis- ciplines op de IC worden nagestreefd en het ontbreken van richtlijnen of protocollen om het vroeg-mobiliseren op de IC te operationaliseren.
In dit artikel wordt een model, het patiënt mobiliseer frame (PMF), geïn- troduceerd dat gebruikt kan worden bij het mobiliseren van patiënten die langdurig op een IC verblijven. In dit model wordt mobiliseren opgevat als het passief of (geleid ondersteund) actief veranderen van de houding van een patiënt in of uit bed met als doel het genezingsproces te bevorderen. Het PMF is ontworpen door C.W. Cas- teleijn, fysiotherapeut op de intensive care van het St. Antonius Ziekenhuis in Nieuwegein.
Het PMF bestaat uit vier frames: twee diagnostische en twee therapeutische frames. De diagnostische frames be- staan uit twee vervolgstappen:
1. één frame met betrekking tot de indeling in belastbaarheidfase A, B of C met behulp van een punten scoresysteem;
2. één matrix-frame voor fase inde- ling in belastbaarheid in combinatie met het medewerkingniveau, bijvoorbeeld: 2B, 1C of 3A.
De twee therapeutische frames zijn:
? een activiteitenframe voor verpleegkundigen in elke fase;
? een activiteitenframe voor fysiotherapeuten in elke fase.
De inhoud van de vier frames is in consensus met IC-verpleegkundigen, intensivisten en fysiotherapeuten uit verschillende ziekenhuis ontstaan in het St. Antonius Ziekenhuis in Nieuwegein.
Het PMF wordt als mobiliseersysteem reeds in vijftien ziekenhuizen gebruikt. Momenteel wordt er gewerkt aan een interbetrouwbaarheid beoordelaarsonderzoek naar de indeling van de belastbaarheidfase A, B en C door drie artsen van de intensive care.
Het patiënt mobiliseer frame
Het PMF zoekt naar grenzen en mogelijkheden om het vroeg-mobiliseren van de patiënten, die langdurig op een intensive care liggen, te operationaliseren. De volgende vragen zijn hierbij van belang:
? Wat is mogelijk bij een patiënt die niet (goed) wakker is?
? Wanneer zijn mobiliseeractiviteiten mogelijk bij een IC-patiënt?
? Mag je een IC-patiënt die beademd wordt mobiliseren?
? Mag mobiliseren inspanning kosten voor de IC-patiënt?
? Hoe en wie mobiliseert een IC-patiënt met (ernstig) spierkrachtverlies?
? Wie initieert op de IC het mobiliseren en wie is verantwoordelijk voor het uitvoeren van de mobiliseeractiviteiten?
Het PMF is gebaseerd op zowel het bewustzijnsniveau als de belastbaarheid van de IC-patiënt. Bewustzijn
en belastbaarheid bepalen samen de mate van mobilisatie van de patiënt. Er dient steeds een balans gezocht te worden tussen de ziektetoestand van de IC-patiënt en de mogelijkheden om te mobiliseren. Bij het zoeken naar deze balans is het van belang dat de verschillende disciplines die bij de IC-patiënt betrokken zijn, dezelfde betekenis toekennen aan bewustzijnsniveau, belastbaarheid en mobilisatie. Het PMF probeert hier eenduidigheid over te geven.
Bewustzijnsniveau
Om mobiliseeractiviteiten te kunnen uitvoeren is de mate van bewustzijn belangrijk. Bij een gesedeerde of (sub) comateuze patiënt zal het mobiliseren beperkt blijven tot passieve vormen zoals wisselligging of positioneren naar half zittende positie in bed. Een medewerkzame patiënt genereert aanzienlijk meer mogelijkheden voor vroeg-mobilisatie. Omdat de patiënt in staat is (eenvoudige) opdrachten uit te voeren, geeft dit de verpleegkundige of fysiotherapeut een beter beeld van de status van het bewegingsapparaat.(8) De patiënt is in staat om actieve bewegingsvormen uit te voeren zoals tot zit komen, staan en lopen. Om de interdisciplinaire communicatie te vereenvoudigen bij het benoemen van het bewustzijnsniveau is een functionele indeling gemaakt. Deze indeling is gericht op de medewerking van een patiënt. In het PMF worden de volgende vier gradaties van bewustzijnsniveau onderscheiden:
0 patiënt reageert nergens op;
1 patiënt geeft enige reactie;
2 patiënt voert eenvoudige opdrachten uit;
3 patiënt is volledig medewerkzaam
Belastbaarheid
Belastbaarheid wordt gedefinieerd als de fysieke en geestelijke draag- kracht die iemand op dat moment kan leveren. In het algemeen is deze draagkracht (sterk) afgenomen bij patiënten in het ziekenhuis en met name op de IC. De belastbaarheid wordt bepaald door de ernst van de ziekte. Over het algemeen zijn bij patiënten die langdurig op een IC verblijven een drietal fasen van ziek-zijn te herkennen:
? een fase van ernstig ziek zijn (fase A);
? een fase van stabilisatie c.q. licht herstel (fase B);
? een fase van verder gaand herstel (fase C).
Via een puntensysteem op basis van medische criteria wordt binnen het PMF onderscheid gemaakt in de drie fasen van belastbaarheid. Het puntensysteem is gebaseerd op dertien items die ondergebracht kunnen worden in de volgende vijf categorieën:
1 circulatie (bloeddruk, hartritme);
2 ventilatie (beademingsvorm, ingestelde zuurstofpercentage);
3 biochemie (Hb en ureum);
4 infectieparameters (lichaamstemperatuur);
5 bijzonderheden (zoals aanwezigheid van fracturen of bijzondere omstandigheden waarvoor bedrust is voorgeschreven).
Per item is een score mogelijk van nul (geen afwijkende waarde) of één punt (afwijkende waarde) en in sommige gevallen van drie punten (ernstig afwijkende waarde). In totaal loopt de score van nul tot zes of meer punten. Met het vastgesteld puntentotaal plaatst de patiënt zich in één van de drie fasen: met nul punten in fase C, één tot vijf punten in fase B en zes punten of meer in fase A. Het indelen van de IC-patiënt in de betref- fende belastbaarheidfase valt onder de verantwoordelijkheid van de arts. Bij twijfel of medische complicaties/ bezwaren die niet in het puntensysteem zijn meegenomen, heeft de arts de mogelijkheid om een puntencorrectie toe te passen. Door de gradering van het bewustzijnsniveau(0-3) tekoppelen aan de belastbaarheidfase (A-C) ontstaat een basismatrix van twaalf verschillende stadia, die de toestand van de IC-patiënt omschrijft (zie figuur 1). Dit vormt het diagnostische basisframe van waaruit de therapeutische frames voor verpleging en fysiotherapie zijn afgeleid.
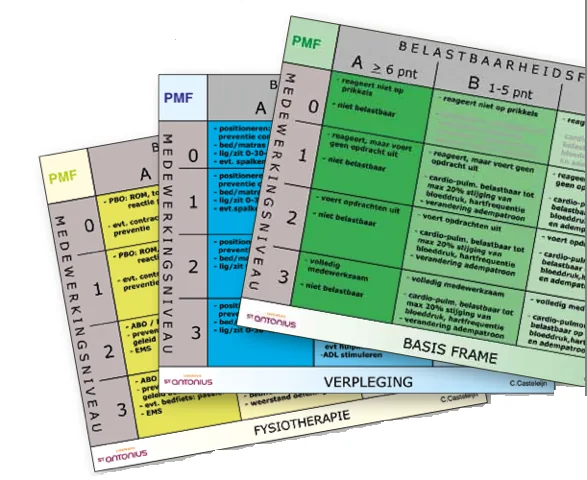
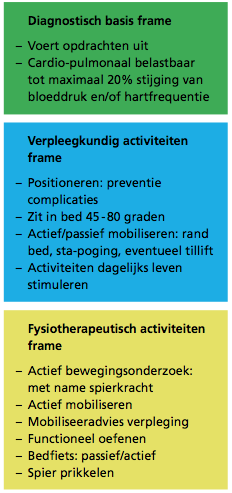
Figuur 1 Het dianostische basisframe en de twee therapeutische frames.
Mobiliseeractiviteiten
Belastbaarheid en mobiliseeractiviteit
In het mobiliseerframe voor verpleging en fysiotherapie worden, vanuit het diagnostisch basis frame, de twaalf verschillende stadia van mobiliseeractiviteiten beschreven. De mate van lichamelijke inspanning wordt vooral bepaald door de belastbaarheidfase. Zo mag van patiënten in belastbaarheidfase A geen enkele vorm van lichamelijke inspanning worden gevraagd. Lichamelijke inspanning wordt herkend aan een verhoogde activiteit van het cardiopulmonale orgaansysteem, zoals veranderingen in hartfrequentie, bloeddruk, adempatroon, ademminuutvolume en saturatie. Door een inspanningsgrens te stellen, wordt de patiënt in fase B beschermd tegen lichamelijke overbelasting. Deze grens ligt cardiaal bij het optreden van eventueel ernstige hartritmestoornissen en bij een stijging van maximaal 20% van hartfrequentie en bloeddruk. Pulmonaal ligt de grens bij direct merkbare verandering van het ademhalingspatroon en een daling van de saturatie. Bij activiteiten van het dagelijks leven (ADL), zoals wassen, eten, verzorging wordt deze marge van 20% ?inspanning-verandering? ook geaccepteerd. Verhoogde lichamelijke inspanning (onder bewaking) mag pas gevraagd worden in fase C waarbij, vergeleken met patiënten in fase B, meer geëist kan worden van het cardiopulmonale systeem (zie figuur 2).
Figuur 2 Voorbeeld van een patiënt in patiënt mobiliseer frame 2B.
Activiteitenkeuze
Wanneer de mate van bewustzijnsniveau en belastbaarheid is bepaald, kan de bijbehorende mobiliseeractiviteit gekozen worden. Deze keuze is afhankelijk van de status van het bewegingsapparaat en de restconditie van de patiënt. Een vast basisonderdeel in elke fase is wisselligging en/of positioneren ter preventie van complicaties, zoals decubitus. In fase B kan met mobiliseren gestart worden middels functioneel bewegen, zoals tot zit komen op de rand van het bed, zelfstandig gaan zitten, tot staan komen, staan, transfer naar stoel en lopen in de walker (zie figuur 3 en 4). Het is een activiteitenreeks die deels passief, geleid actief en actief uitgevoerd kan worden en afhankelijk is van de motorische toe- stand waarin de patiënt verkeert. Verder wordt in fase B aandacht besteed aan bewegingsbewust wording en ADL-activiteiten. In fase C zal een aanvang gemaakt worden met het belasten van het cardiopulmonale systeem. Door de beweegvormen uit fase B te herhalen en te verzwaren wordt actief getraind en direct aan de conditie van de patiënt gewerkt.
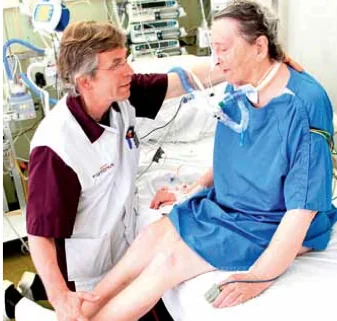
Figuur 3 Beenspierkracht wordt beoordeeld door de fysiotherapeut.
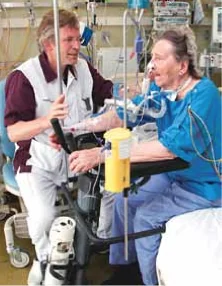
Figuur 4 Gebruik van de walker bij het oefenen van de zitstabiliteit.
Uitvoering van de activiteiten
Bij stoornissen van het bewegingsapparaat bepaalt de fysiotherapeut de fysieke mobiliseermogelijkheden van de patiënt. Het mobiliseren kan afhankelijk van de ernst van de motorische stoornis samen met de verpleegkundigen uitgevoerd worden. De fysiotherapeut geeft advies aan de verpleging ten aanzien van veiligheid en uitvoering van de mobiliseeractiviteiten.(9) Indien nodig voert de fysiotherapeut tevens interventies uit als oefentherapie, passieve bewegingen, gebruik van de bedfiets of ander oefenmateriaal.(10) Bij patiënten met ernstig spierkrachtverlies kunnen bovenstaande interventies passief of geleid actief uitgevoerd worden. Voor de verpleging is het belangrijk motorische problemen en/of ernstig pierkrachtverlies te herkennen en vervolgens de expertise van de fysiotherapeut in te roepen. Het mobiliseren van deze patiënten vraagt om een veilige en zorgvuldige aanpak.(11) Het vertrouwen in de motorische mogelijkheden van het lichaam van de patiënt mag niet nog meer beschadigd worden. Indien er geen stoornissen van het bewegingsapparaat zijn, wordt het mobiliseren uitgevoerd door verpleegkundigen. Wisselligging en positionering vindt volgens protocol plaats om de 2 à 3 uur. In fase B zullen minimaal twee en in fase C minimaal drie mobiliseeractiviteiten per dag plaatsvinden exclusief de eventuele fysiotherapeutische behandeling.
Beperkingen bij het uitvoeren van activiteiten
Elke patiënt op de intensive care heeft lijnen, infusen, tubes, canules en andere invasieve lijnen. Deze materialen kunnen de uitvoering van bepaalde obiliseeractiviteiten (deels) beperken. Niet de belastbaarheid maar de lijnen zijn dan de beperkende factor zoals een dialysekatheter in de lies, intracerebrale drukmeting (ICP), en- dotracheale tube of IABP en ECMO- katheters.
Niet de belastbaarheid maar lijnen kunnen een beperkende factor zijn in het uitvoeren van activiteiten. Een dialyselijn in de lies mag geen reden zijn om een patiënt geïmmobiliseerd te laten liggen. Er zal onder deze omstandigheden gekeken moeten worden naar andere mogelijkheden om veilig te mobiliseren of middels oefentherapie door de fysiotherapie. Daarnaast zullen de uitvoerders van het mobiliseren, het mobiliseermoment moeten aanpassen aan de omstandigheden van de patiënt met betrekking tot wassen, onderzoeken, bezoek, mentale toestand, etc.
Interdisciplinaire afstemming
Het PMF biedt de mogelijkheid om het gehele mobiliseerproces inzichtelijk te maken en de communicatie over het mobiliseren voor alle medewerkers op de IC te structureren.
Het PMF is bedoeld voor patiënten die door opgelopen complicaties langdurig op de IC moeten verblijven
en daardoor buiten bestaande mobiliseerprotocollen vallen. De arts start rond de vijfde dag van de IC-opname met het bepalen van de belastbaarheid in het diagnostisch basisframe. Dit wordt door de arts minimaal eenmaal per dag gedaan, bij voorkeur op een vast tijdstip in de ochtend. Vervolgens kunnen de verpleging en fysiotherapie beginnen met hun mobiliseeractiviteiten. Bij aanvang van deze activiteiten zijn de uitvoerders verantwoordelijk voor het controleren van de door de arts bepaalde belastbaar- heidfase. Dit betekent dat ook verpleging en fysiotherapie het diagnostisch basisframe goed moeten kennen en hanteren om zo te kunnen anticiperen op een veranderde patiëntstatus.
Elke discipline heeft binnen het PMF zijn eigen taken. De arts stelt de belastbaarheidfase A, B of C van het diagnostisch basisframe vast. De verpleging verzorgt, coördineert en mobiliseert patiënten zonder moto- rische stoornissen. De fysiotherapeut mobiliseert patiënten met motorische stoornissen en/of ernstig spierkracht- verlies, bepaalt de fysieke mogelijk- heden, adviseert de verpleging op dit gebied en voert fysiotherapeutische interventies uit. Het optimale resultaat van het PMF komt voort uit deze interdisciplinaire samenwerking en afstemming.
Discussie en conclusie
Met het PMF is een poging gedaan om de belastbaarheid van een IC-patiënt te objectiveren. Het PMF heeft het bewustzijnsniveau en de belastbaarheid van de IC-patiënt als de twee pijlers genomen voor de keuze van een mobiliseerschema. Het PMF is een gebruiksvriendelijk model waarin snel en overzichtelijk elke op de IC gelegen patiënt ingedeeld kan worden. Ook patiënten die niet goed wakker zijn, beademd en/of gedialyseerd worden, kunnen gemobiliseerd worden, kunnen vroeg gemobiliseerd worden. Het PMF maakt het mobiliseren van de patiënt op de IC transparant, waardoor een betere interdisciplinaire afstemming van het beleid mogelijk wordt. Door deze afstemming kunnen realistische doelen worden gesteld, hetgeen de patiënt ten goede komt.
Het is niet eenvoudig om de complexe medische toestand van een IC-patiënt op zijn of haar lichamelijke belastbaarheid te beoordelen. In de praktijk blijkt dat belastbaarheid vaak subjectief beoordeeld wordt en door de verschillende disciplines anders geïnterpreteerd. Deze subjectieve interpretatie, in combinatie met het wel of niet hebben van contraindicaties, is het wankele huidige beleid om te bepalen of een IC-patiënt gemobiliseerd kan worden.
Verder onderzoek zal gedaan moeten worden om een wetenschappelijk onderbouwing te kunnen geven over zowel de indeling in belastbaarheidfase als de gradering in bewustzijnsniveau. Het PMF-algoritme vindt zijn oorsprong in een praktisch denkpatroon van vele jaren ervaring als IC-fysiotherapeut. Om het PMF verder te kunnen ontwikkelen en implementeren zal onderzoek naar de bruikbaarheid en effectiviteit van het PMF nodig zijn.
Mijn hartelijke dank aan dr. P. Bruins (intensivist) en dr. E. Tromp (klinisch epidemioloog) van het St. Antonius Ziekenhuis, voor hun bijdrage aan dit artikel.
Literatuur
1 Clavet H, Hebert PC, Fergusson D, Doucette S, Tru- del G. Joint contracture following prolonged stay in the intensive care unit. CMAJ 2008;178(6):691-7.
2 Winkelman C. Inactivity and inflammation: selec- ted cytokines as biologic mediators in muscle dys- function during critical illness. AACN Clin Issues 2004;15(1):74-82.
3 Needham DM. Mobilizing patients in the intensive care unit: improving neuromuscular weakness and physical function. JAMA 2008;300(14):1685-90.
4 Thomas A. Physiotherapy led early rehabilitation of the patient with critical illness. Physical The- rapy Reviews 2011;16.
5 Burtin C, Clerckx B, Robbeets C, Ferdinande P, LangerD,TroostersT,etal.Earlyexerciseincriti- cally ill patients enhances short-term functional recovery. Crit Care Med 2009;37(9):2499-505.
6 Morris PE, Goad A, Thompson C, Taylor K, Harry B, PassmoreL,etal.Earlyintensivecareunitmobi- lity therapy in the treatment of acute respiratory failure. Crit Care Med 2008;36(8):2238-43.
7 Schweickert WD, Pohlman MC, Pohlman AS, Nigos C, Pawlik AJ, Esbrook CL, et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: a randomised controlled trial. Lancet 2009;373(9678):1874-82.
8 Hough CL, Lieu BK, Caldwell ES. Manual muscle strength testing of critically ill patients: feasi- bility and interobserver agreement. Crit Care 2011;15(1):R43.
9 Garzon-Serrano J, Ryan C, Waak K, Hirschberg
R, Tully S, Bittner EA, et al. Early mobilization in critically ill patients: patients? mobilization level depends on health care provider?s profession. PM R 2011;3(4):307-13.
10 GosselinkR,RobbeetsC,VanhullebuschT,Van- pee G, Segers J. Physiotherapy in the Intensive Care Unit. Netherlands Journal of Critical Care 2011;15.
11 StillerKPA.Safetyaspectsofmobilisingacutely ill inpatients. Physiotherapy Theory and Practice 2003;19.






